中国科学院遗传与发育生物学研究所田烨课题组在 Nature Communications 期刊发表了题为:ASI-RIM neuronal axis regulates systemic mitochondrial stress response via TGF-β signaling cascade 的研究论文。
该研究发现,TGF-β信号通路通过ASI-RIM神经元轴调控神经-肠道的跨组织UPRmt的激活,此过程依赖于神经递质多巴胺,并受到GABA的负调控,该研究还揭示了TGF-β信号通路对于线虫寿命、免疫和脂质代谢的调控作用。

在这项新研究中,研究团队首先鉴定到了形态发生素TGF-β配体daf-7(在哺乳动物中的同源基因为GDF11)基因失活显著抑制神经组织线粒体损伤诱导的细胞非自主性UPRmt。同时,daf-7所在的TGF-β Dauer信号通路的各个组分对于系统性UPRmt的激活都是必须的。进一步研究证明,仅在一对ASI神经元抑制daf-7的功能,就可以抑制神经-肠道线粒体应激信号的传递,并且,从ASI神经元中释放的配体DAF-7,通过RIM神经元上的受体DAF-1,激活下游的TGF-β Dauer信号通路,进而诱导肠道细胞的UPRmt。
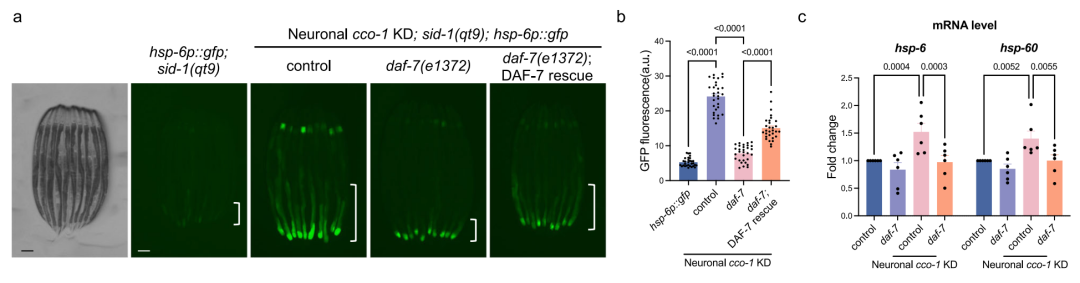
TGF-β配体DAF-7介导细胞非自主性UPRmt
研究团队发现,仅在ASI神经元中造成线粒体损伤,就足以激活肠道中的UPRmt。在此模型中,UPRmt的激活不仅依赖于ASI-RIM神经元轴和TGF-β Dauer信号通路,还依赖于神经递质多巴胺并受到GABA的负调控。此外,此前已被鉴定到的参与整个神经组织线粒体损伤激活肠道UPRmt的mitokine:Wnt配体EGL-20、二硫键异构酶PDI-6以及GPCR组分SRZ-75,并不参与此模型中UPRmt的激活。说明当神经组织的线粒体受损时,多种mitokine信号可能会通过不同方式,将不同神经元的应激信号传递至外周组织。
随后,研究团队对神经组织线粒体损伤模型线虫的生理表型进行了检测,发现其具有更长的寿命、更强的致病菌抗性和更少的脂质累积,这些生理表型的改变也同样依赖于ASI神经元分泌的DAF-7和RIM神经元中的受体DAF-1。
综上所述,这项研究揭示了一对ASI神经元中的线粒体损伤跨组织激活UPRmt的分子机制——TGF-β Dauer信号通路通过ASI-RIM神经元轴,系统性调节蛋白稳态,并强调了TGF-β在调节机体的适应性变化、代谢改变和衰老进程等方面的关键作用。由于TGF-β信号的具有很高的保守性,因此,在哺乳动物中通过操纵TGF-β信号协调线粒体应激信号,以调控机体的健康衰老将成为可能。同时,靶向特定神经元中的感觉输入或相应受体,也可作为维持线粒体稳态和平衡脂质累积水平的一种有前景的途径。
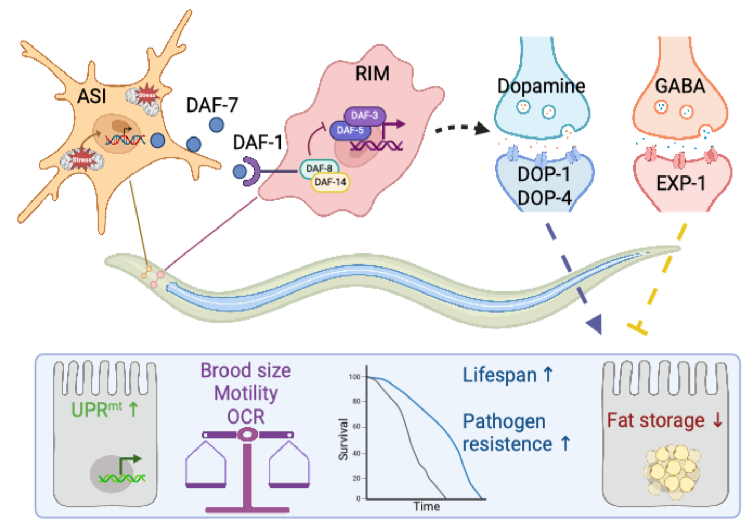
ASI-RIM神经元轴通过TGF-β信号通路协调系统性线粒体应激反应
中国科学院遗传与发育生物学研究所田烨课题组博士生王子豪和博士后张茜为论文共同第一作者,参与该工作的还有硕士生蒋亚云和博士生周俊,田烨研究员为论文通讯作者。
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。