环状RNA(circRNA)是一种新兴的内源性非编码RNA(ncRNA),它们参与细胞增殖、粘附、凋亡和存活等多个生物学过程[1]。
近年来,circRNAs在肿瘤领域也获得了越来越多的关注。有研究表明许多circRNA能促进细胞周期发展,抑制或诱导肿瘤细胞凋亡以及抑制血管生成等等[2],各种不同的circRNAs在肿瘤发生发展过程中起着不同甚至相反的作用。
虽然越来越多的研究报道了乳腺癌、肺癌和结直肠癌中异常的circRNAs[3],但circRNAs在肿瘤细胞中的生物学功能、分子机制和环状模式尚不清楚。此外,还有研究提出circRNAs可以通过病理功能未知的外泌体分泌到循环中[4],且比线性RNAs更容易被分选进入外泌体。然而,circRNAs的外泌体特异性分选机制也仍然完全未知。
近日,来自浙江大学张红河和中国药科大学来茂德领衔的研究团队,阐明了circRHOBTB3在结直肠癌(CRC)进展中的生物学作用、环化过程和分泌途径,这一结果发表在Molecular Cancer期刊上。
他们发现,抑瘤circRHOBTB3通过外泌体被癌细胞排出,以维持结直肠癌细胞的活性。此外,他们还设计了靶向circRHOBTB3的环状化和分泌元件的反义寡核苷酸(ASOs),用于CRC的治疗。

论文首页截图
circRHOBTB3是宿主基因RHOBTB3转录后剪接和环状化而产生的一种circRNA。RHOBTB3作为Rho GTPase家族ATP酶,参与膜转运[5、6]和蛋白酶体降解[7]。
先前的研究也表明circRHOBTB3在CRC、卵巢癌、胃癌和肝细胞癌(HCC)中作为肿瘤抑制circRNA。然而,它的循环模式和外泌体分泌途径并未被阐释。
首先,研究人员分析了来自GEO数据库的12例CRC患者、21例HCC患者、32例胰腺腺癌(PAAD)患者和14例健康供体的血清外泌体的总RNA-seq数据。
结果显示,许多circRNAs在肿瘤患者血清外泌体中的表达程度不同(图1A),但在所有三种癌症来源的外泌体中,只有hsa_circ_0007444(circRHOBTB3)均表达上调(图1B),且其宿主基因RHOBTB3在三种肿瘤组织中的表达与正常组织相比均无显著性的增强(图1C)。
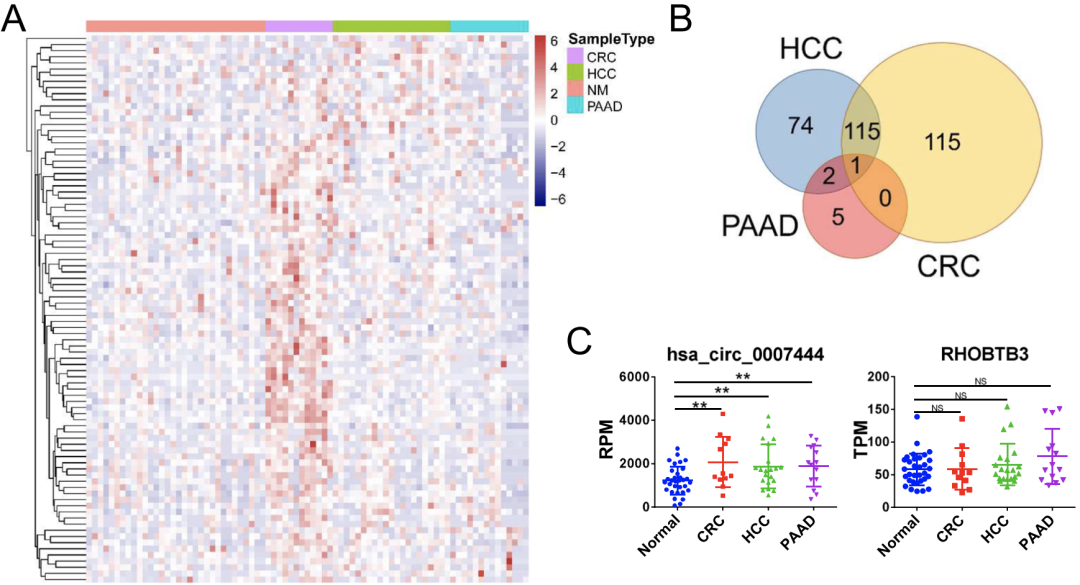
图1 不同类型癌症中ircRHOBTB3在患者血清外泌体中的表达情况
然而,对来自浙江大学医学院邵逸夫医院体检的18例CRC患者和16例健康供者的血清样本数据分析发现,与健康供者相比,circRHOBTB3在CRC组织中显著下调,而宿主基因RHOBTB3显著上调(图2左二)。而且,在69个CRC组织样本中检测到的circRHOBTB3的表达结果显示,circRHOBTB3水平较高患者的总生存期更好(图2右一)。
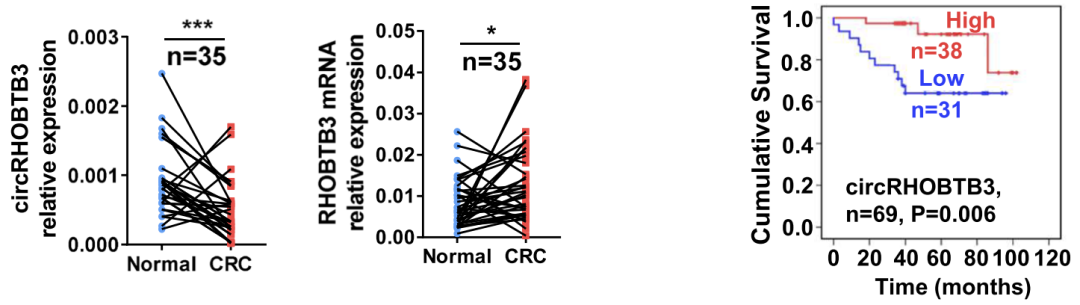
图2 ircRHOBTB3在CRC组织中患者血清外泌体中的表达情况
于是,研究者不禁假设,circRHOBTB3是否具有抑癌作用?
为了验证这一点,他们先确定了CRC患者血清外泌体中的circRHOBTB3确实来源于肿瘤细胞而非基质细胞(图3A),且circRHOBTB3水平在来自NCM460细胞(正常的肠上皮细胞系)的外泌体中最低(图3B)。进一步在RKO、HCT116细胞(CRC细胞系)中过表达或敲低circRHOBTB3,结果表明circRHOBTB3可以抑制细胞迁移和侵袭能力(图3C)。
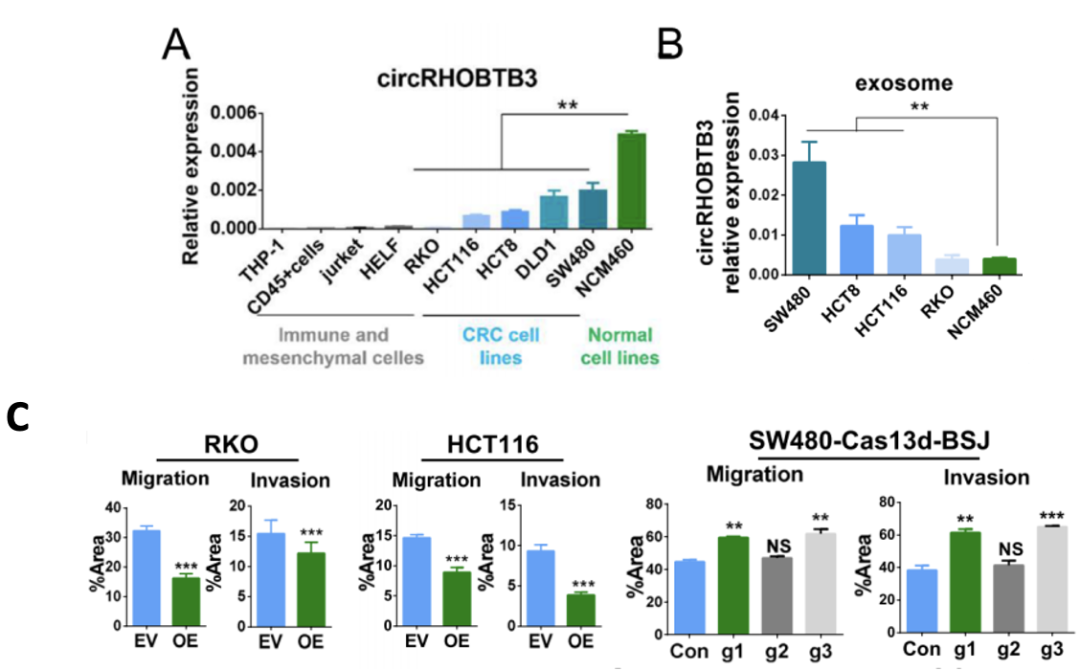
图3 circRHOBTB3来源与功能的体外验证实验
并且,他们通过对circRHOBTB3敲除/重新表达细胞系RNA-Seq数据的分析,以及RT-qPCR验证发现,在circRHOBTB3敲除的细胞系中代谢、增殖和上皮间充质转化(EMT)通路相关基因显著上调,而circRHOBTB3的重新表达降低了这些基因的表达。此外,circRHOBTB3敲除的细胞系中ROS水平也显著升高。
他们还发现circRHOBTB3的结合蛋白是ENO1和ENO2。也就是说,circRHOBTB3可能通过与ENO1和ENO2等代谢酶相互作用,调节细胞内ROS水平,抑制肿瘤细胞增殖和EMT。
为了验证circRHOBTB3在体内的功能,研究人员将过表达circRHOBTB3的HCT116细胞(CRC细胞系)皮下注射到裸鼠体内,构建了异种移植瘤模型。研究发现,与不表达circRHOBTB3的对照(EV)组相比,circRHOBTB3过表达(circRHOBTB3-OE)组的肿瘤体积和重量都显著更小,且细胞增殖能力也更弱(图4A、B、C)。
而当他们在裸鼠脾脏接种实验中观察肝转移表型时发现,circRHOBTB3-OE组肝转移灶少于EV组(图4D、E)。更为有趣的是,circRHOBTB3可以在异种移植瘤小鼠模型的血浆和尿液中检测到,而在野生型小鼠的血浆和尿液中则没有。此外,circRHOBTB3-OE组的血浆中circRHOBTB3的水平高于EV组(图4F、G)。
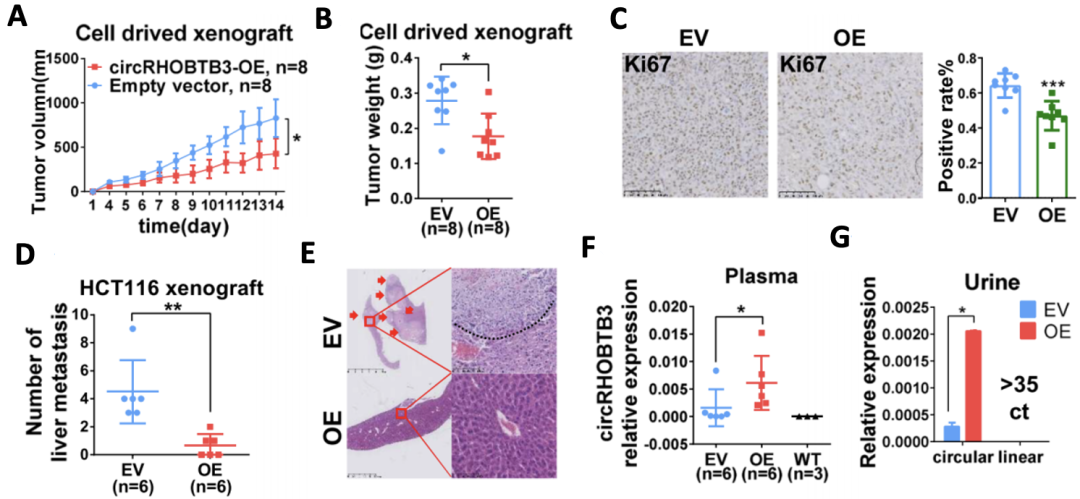
图4 circRHOBTB3功能的体内验证实验
根据这些数据,研究者们推测CRC细胞必须通过外泌体分泌抑制肿瘤的circRHOBTB3来维持肿瘤侵袭和转移的特征,换言之,CRC细胞有特殊的“排毒”机制。
在随后的研究中,研究人员发现了circRHOBTB3的环化机制,还发现circRHOBTB3本身的顺式元件(141–240nt,141-165nt,216-240nt)可以调节circRHOBTB3通过外泌体的分泌过程(图5)。
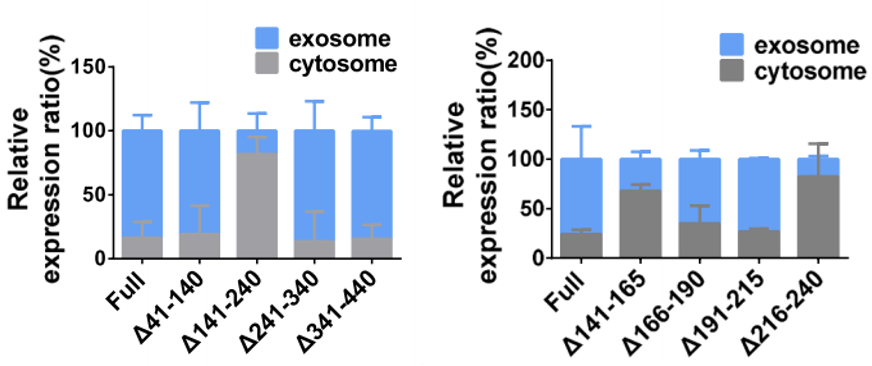
图5 转染了截断的circRHOBTB3载体的细胞中circRHOBTB3外泌体分泌丰度
之前已经有研究发现,ESCRT-II亚复合物作为一种RNA结合复合物,可以将RNA分选至外泌体[8]中。在该文研究中,他们发现SNF8可以结合到circRHOBTB3的141-240nt区域,促进circRHOBTB3被分选至外泌体并分泌到胞外。他们将这个过程被定义为“肿瘤外泌体逃逸机制”(图6)。

图6 SNF8敲低实验以及外源的RIP实验
受上述研究结果启发,研究人员设计了二代ASOs,以增加circRHOBTB3的环化并减少分泌,这有望成为一种新的癌症治疗策略。
研究人员设计了三种二代ASOs:一个靶向负环化的元件(ASO-cir:266-290nt)和两个外泌体分泌的元件(ASO-exo1:141-165nt,ASO-exo2:216-240nt)(图7)。
通过实验他们发现,ASO-cir确实能增加circRHOBTB3的环化,但circRHOBTB3的分泌却会同时增加;而ASO-exo1和ASO-exo2中,仅ASO-exo2(以下简称ASO-exo)既增加circRHOBTB3的胞内水平,又阻断circRHOBTB3外泌体的分泌。因此,研究者们考虑进一步使用ASO-cir和ASO-exo,研究二者联合治疗对结直肠癌的特异性和抗肿瘤效果。
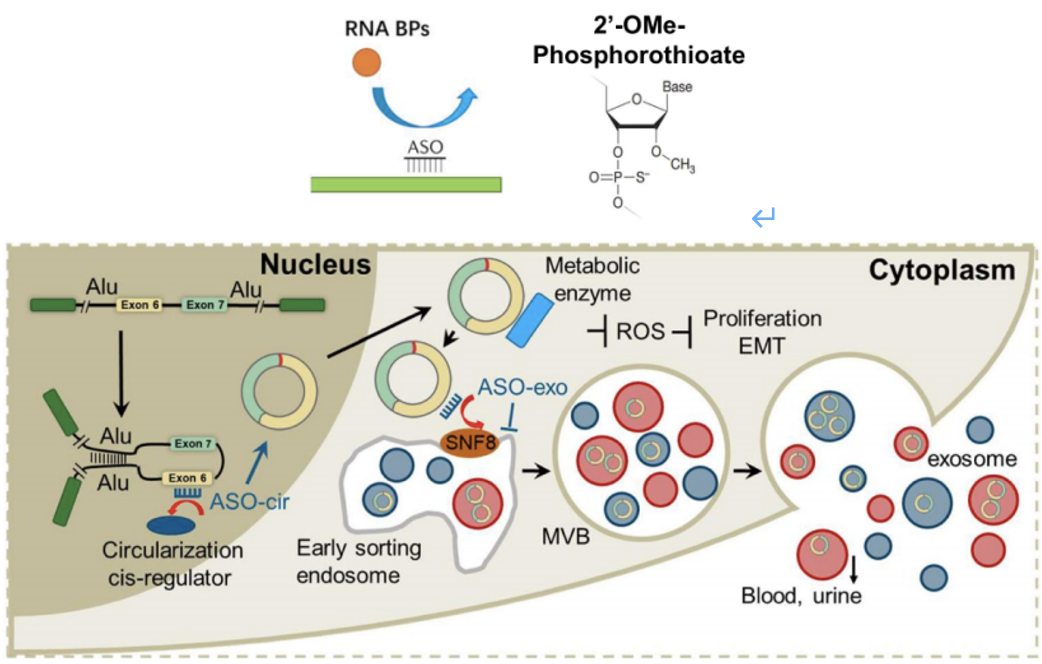
图7 二代ASOs及其作用机制
研究人员验证了ASOs的联合用药的确比ASO-cir和ASO-exo的单独用药能产生更多的胞内circRHOBTB3,且小鼠实验的结果符合预期:ASO-cir联合ASO-exo确实显著提高了脾脏原发病灶中circRHOBTB3的表达,还可显著减少肿瘤恶病质,且能控制转移(图8)。
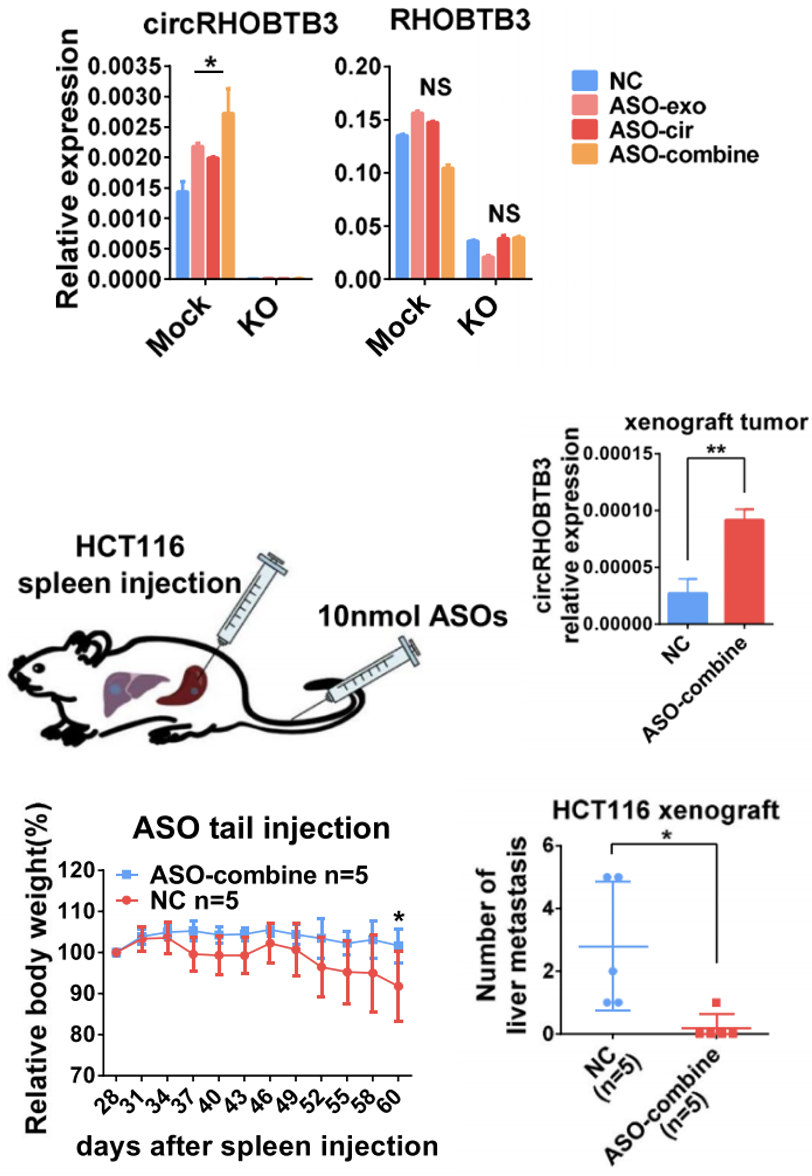
图8 ASOs体外及体内实验
总的来说,这项研究成果阐明了circRHOBTB3调节细胞间ROS和代谢途径来抑制CRC的进展的机制,还且提出了一种新的肿瘤逃逸理论,即肿瘤细胞通过“排泄”肿瘤抑制circRNA来维持癌细胞的活性(“肿瘤外泌体逃逸机制”)。
更重要的是,他们设计的二代ASOs可以通过靶向环化和分泌来调控肿瘤抑制circRNA,以此促进癌症的治疗效果。且他们的临床数据显示,在CRC患者中,85.7%(30/35)的肿瘤样本携带的circRHOBTB3水平低于配对的正常样本,而肿瘤样本中circRHOBTB3的低表达与较差的预后相关。这让我们更加相信,这种ASOs将成为未来针对CRC的一种有前途的治疗策略。
小编推荐会议 2022(第六届)细胞外囊泡前沿与转化大会
http://meeting.bioon.com/2022Exosomes/intro
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。