2017年9月28日/生物谷BIOON/---外泌体是一种存在于细胞外的多囊泡体,可通过细胞内吞泡膜向内凹陷形成多泡内涵体,内涵体与细胞膜融合后释放其中的小囊泡。外泌体的直径在40-110 nm之间,其中包含RNA、蛋白质、microRNA、DNA片段等多种物质,存在于血液、唾液、尿液、脑脊液和母乳等多种体液中。外泌体从发现至今已有30多年的历史,虽然最初被认为可能是细胞的“垃圾”,所以才被排出来,但是近年来研究表明外泌体具有功能活性并可进行细胞间信息传递。如今,研究已经发现外泌体在抗原提呈细胞中呈递抗原程中、肿瘤细胞发生发展、神经细胞信号转导过程中都发挥着重要作用。
1.Cell:糖尿病研究新突破!脂肪组织巨噬细胞分泌的外泌体能够调节胰岛素抵抗性
doi:10.1016/j.cell.2017.08.035

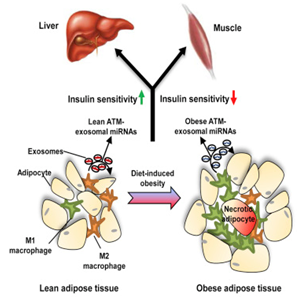
图片来自Cell, doi:10.1016/j.cell.2017.08.035。
由肥胖导致的慢性组织炎症是胰岛素抵抗性和2型糖尿病产生的一种根本原因。但是这种发生的机制在此之前一直是未知的。
在一项新的研究中,来自美国加州大学圣地亚哥分校和中国医学科学院/北京协和医学院的研究人员鉴定出外泌体(exosome)是其中缺失的一环。相关研究结果于2017年9月21日在线发表在Cell期刊上,论文标题为“Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro Insulin Sensitivity”。
论文通信作者、加州大学圣地亚哥分校医学院内分泌新陈代谢内科医学教授Jerrold Olefsky博士说,“当外泌体在组织之间迁移时,它们诱导的反应可能是导致糖尿病中的代谢错乱的细胞间通信的一种根本原因。通过对细胞进行荧光标记,我们能够观察到外泌体和它们携带的微RNA(microRNA, miRNA)从脂肪组织经过血液,渗透到肌肉组织和肝组织中。”
Olefsky团队获取在肥胖小鼠的脂肪组织中发现的巨噬细胞,并且收集它们分泌的外泌体。苗条的健康小鼠接受这些“肥胖的”外泌体的处理。他们发现尽管这些之前正常的小鼠并不会体重超重,但是它们也开始表现出肥胖诱导的胰岛素抵抗性。
当逆转这种过程时,Olefsky团队发现当利用来自苗条小鼠的外泌体处理肥胖小鼠时,他们能够恢复这些肥胖小鼠的胰岛素敏感性。这些肥胖小鼠保持体重超重,但是在代谢上是健康的。
类似地,在体外研究期间,当利用“肥胖的”外泌体处理人肝细胞和脂肪细胞时,这些细胞产生胰岛素抵抗性。相反地,当它们接受“苗条的”巨噬细胞外泌体处理时,它们对胰岛素高度敏感。
2.Nature子刊:中科院广州生物院陈小平研究组揭示疟原虫感染小鼠血浆外泌体抑制肿瘤血管生成的分子机制
doi:10.1038/oncsis.2017.52
2017年6月26日,国际学术权威刊物自然出版集团旗下子刊《Oncogenesis》杂志上在线发表了中国科学院广州生物医药与健康研究院陈小平课题组的最新研究成果“Exosomes from Plasmodium-infected hosts inhibit tumor angiogenesis in a murine Lewis lung cancer model”。研究首次发现疟原虫感染小鼠血浆外泌体(exosomes)能够抑制肿瘤血管生成,并初步阐明其分子机制。研究加深了对疟原虫感染宿主所分泌的外泌体与肿瘤血管生成之间的相互作用的认识,为开发疟原虫感染来源的外泌体作为一种新型抗肿瘤制剂奠定了基础。博士研究生杨一峻为论文第一作者,陈小平博士为论文通讯作者。
研究人员选用肺癌小鼠模型作为研究对象,从感染疟原虫的小鼠血浆中获得外泌体,并将这些外泌体注射到小鼠的肿瘤内部,并与没有疟原虫感染的小鼠血浆外泌体进行对照。研究发现,疟原虫感染小鼠的血浆外泌体显著抑制肿瘤血管的生成。进一步的研究发现,疟原虫感染的小鼠血浆外泌体通过至少四种特殊的微小RNA(miR16-5p/17-5p/322-5p/497-5p)抑制血管内皮细胞 VEGF受体(VEGFR2)的 表达从而阻断血管生成的信号通路。这些发现加深了人们对疟原虫抗癌机理的理解,并为疟原虫疗法治疗癌症的临床研究提供进一步的理论依据。
3.Nature:重大突破!利用靶向KRAS突变基因的外泌体治疗胰腺癌
doi:10.1038/nature22341

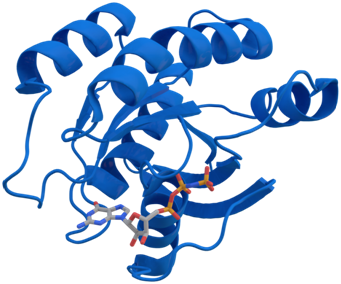
KRAS蛋白晶体结构,图片来自Thomas Splettstoesser/Wikipedia。
外泌体(exosome)是所有细胞释放出的病毒大小的颗粒。它们天然地存在于血液中。根据来自美国德州大学MD安德森癌症中心的一项新的研究,对外泌体进行基因操纵可能提供一种新的胰腺癌治疗方法。相关研究结果于2017年6月7日在线发表在Nature期刊上,论文标题为“Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer”。论文通信作者为德州大学MD安德森癌症中心癌症生物学系研究员Raghu Kalluri博士。
在这项新的研究中,经过基因修饰的外泌体(被称作iExosome)能够运送特异性地靶向KRAS突变基因的小RNA分子,从而导致胰腺癌模式小鼠病情缓解,增加它们的总存活率。这些研究人员采用了一种被称作RNA干扰(RNAi)的靶向方法:利用这些天然的纳米颗粒(即外泌体)运送小干扰RNA(siRNA)或短发夹RNA(shRNA)分子来靶向胰腺癌细胞中的KRAS突变基因,从而影响多种胰腺癌模型的肿瘤负荷和存活。他们证实外泌体能够作为一种高效的RNAi载体发挥作用,这是因为这些纳米大小的囊泡(即外泌体)轻松地在体内迁移和进入靶细胞(包括癌细胞)中。
作为一种分子通断开关的KRAS发生突变时会处于“开启”状态。在80%~95%的胰腺导管腺癌(PDAC)当中,这个基因发生突变,这也是这种癌症中最为常见的突变。这些研究人员证实iExosome能够运送特异性地靶向KRAS的siRNA和shRNA分子,并且比他们的合成对应物脂质体(liposome)更加高效。脂质体不具有外泌体表现出的天然复杂性和优势。
德州大学MD安德森癌症中心癌症生物学助理教授Valerie LeBleu博士说,“我们的研究提示着与脂质体相比,外泌体表现出运送siRNA分子和抑制侵袭性胰腺瘤生长的优异能力。我们也证实外泌体表面上的CD47存在允许它们躲避来自循环单核细胞的吞噬作用。”
这些研究人员也证实一种被称作巨胞饮(macropinocytosis)的细胞过程促进发生KRAS基因突变的癌细胞摄取外泌体。巨胞饮参与细胞清除营养物和囊泡。
Kamerkar说,“与之前的发现相一致的,由于增加的巨胞饮过程,达到胰腺的外泌体数量增加可能为外泌体进入KRAS相关的癌细胞提供进一步的优势。尽管胰腺瘤存在致密的基质,我们的结果也支持癌细胞高效地摄取iExosome。还需开展进一步的研究以便更好地理解通过巨胞饮进入细胞中的外泌体是否具有其他的可能增强它们的抗肿瘤能力的特征。”
4.Cell:外泌体介导了果蝇的抗病毒适应性免疫
doi:10.1016/j.cell.2017.03.033; doi:10.1016/j.cell.2017.03.032
几十年来,果蝇一直是先天免疫研究的模式动物。在最新一期的Cell杂志上,加州大学旧金山分校Tassetto教授等人描述了抗病毒RNAi扩散的机制,通过反向转录的vDNA环和包含小RNA的外泌体全身传播,相当于哺乳动物适应性免疫。
多细胞生物体内有效的抗病毒保护依赖于细胞和全身免疫。系统免疫介导了抗病毒信号从感染部位扩散到远处的未感染组织。在节肢动物中,RNA干扰(RNAi)负责抗病毒防御。该研究显示果蝇具有由巨噬细胞样血细胞介导的复杂的基于全身RNAi的免疫。血细胞从感染的细胞中摄取dsRNA,通过内源转座子逆转录酶产生病毒衍生的互补DNA(vDNA)。这些vDNA模板从头合成二级病毒siRNA(vsRNA),分泌到外泌体样囊泡中。有趣的是,从感染果蝇的血淋巴中纯化的含有vsRNA的外泌体,在幼稚动物中赋予了针对病毒攻击的被动保护。因此,类似于脊椎动物,昆虫使用免疫细胞产生免疫记忆,其形式是稳定的vDNA,产生由含有vsRNA的外泌体介导的全身免疫。
5.上海交大附属六院张长青教授团队:血浆外泌体抑制糖皮质激素相关的内质网应激诱导的凋亡可减轻股骨头坏死
doi:10.7150/thno.17450
据报道,过量的糖皮质激素(GC)是股骨头坏死(ONFH)的最常见原因之一。此外,GC可以通过调节内质网(ER)应激诱导骨细胞凋亡。在ER应激的三个主要信号途径中,PERK(蛋白激酶RNA样ER激酶)/ CHOP(CCAAT-增强子结合蛋白同源蛋白)途径被认为与凋亡密切相关。富含血小板的血浆(PRP)具有极高浓度的生长因子,PRP来源的外泌体(PRP-Exos)具有与PRP相似的作用。大量的生长因子可以封装到PRP-Exos中,并激活Akt和Erk途径以促进血管生成。Akt途径的激活可促进抗凋亡蛋白如Bcl-2的表达,而CHOP可以抑制Bcl-2的表达,以增加cleaved caspase-3的水平并导致细胞死亡。因此,来自上海交大附属六院整形外科的张长青教授团队假设PRP-Exos通过Akt/Bad/Bcl-2信号通路阻止大鼠ONFH中糖皮质激素相关的ER应激诱导的凋亡。为了验证这一假设,采用地塞米松(DEX)处理的体外细胞模型和甲基泼尼松龙(MPS)处理的体内大鼠模型。检测PRP-Exos的表征以及PRP-Exos对体外和体内用GC处理的细胞的增殖、凋亡、血管生成和成骨作用的影响。此外,还研究了PRP-Exos通过Akt/Bad/Bcl-2途径拯救GC诱导的细胞凋亡的机制。这些结果表明,PRP-Exos通过在ER应激情况下通过Akt/Bad/Bcl-2信号通路促进Bcl-2表达,具有预防大鼠模型中GC诱导的细胞凋亡的能力。
6.前列腺癌非侵入性的诊断和监测新方式——外泌体
doi:10.1007/s10853-017-0905-0
华盛顿州立大学(Washington State University,WSU)的研究人员设计了一个镶嵌有特殊生物标记物的微小玻璃弹簧垫,可以吸引由肿瘤细胞释放入体液的含有蛋白质和RNA的脂质包裹物。这种脂质包裹物被称为外泌体,包含许多可分析的遗传信息,能够确定癌症的分子组成,甚至知道癌症的进展程度。
伯克曼、Parissa Ziaei博士(跨学科材料科学和工程计划的学生)以及机械和材料工程教授格兰特·诺顿(Grant Norton)在Springer旗下的Journal of Materials Science杂志上发表了该项研究,他们表示,他们的捕获技术比以前的方法更有效地将前列腺肿瘤外泌体与其他细胞信息分离开来。
除了帮助医生监测前列腺癌的进展外,WSU的研究人员希望他们的新方法还可以应用于帮助治疗患有其他类型的癌症和其他疾病的患者。在诺顿实验室合成的玻璃纳米螺旋过滤设备可以装载各种生物标志物,用来捕获尿液、血液和其他体液中的癌症外泌体。
7.PNAS:重磅:华人科学家在外泌体液体活检领域取得重大突破
doi:10.1073/pnas.1618088114
近日,普渡大学陶纬国(W. Andy Tao)教授团队在癌症的液体活检领域做出了「突破性贡献」,他们通过分析血液中囊泡(extracellular vesicles,EVs;包括近几年颇受业界关注的外泌体在内)内的磷酸化蛋白,实现了检测癌症的目的。本月初,著名期刊《美国科学院院报》刊登了陶教授团队的这一重要研究成果(1),研究的第一作者是来自宝岛台湾的I-Hsuan Chen。
通过检测身体蛋白磷酸化状态来检测癌症,看上去是靠谱的,但是据普渡大学报道,截止陶教授的这篇论文发表前,学界都认为通过血液检测磷酸化蛋白是不太现实的,原因是肝脏在源源不断的往血液中释放磷酸酶,已经磷酸化的蛋白到了血液,它的磷酸都被搞掉了,没办法检测了。
为了解决这个问题,陶教授团队将目光盯在了近几年非常热的囊泡上。这些囊泡都是从不同的细胞上分离出来的小泡泡,它们携带着母细胞的DNA、RNA和蛋白质等信息,通过分析小泡泡可以直接获得母细胞的基本信息。由于血液中散布的囊泡有一层膜保护,因此它们非常稳定,基本不受外界环境的干扰。所以陶教授认为,囊泡里面的磷酸化蛋白也不会受到血液中去磷酸化酶的干扰。
于是陶教授团队从Indiana Biobank收集了保存了5年(有研究表明30年「陈酿」的血样里的外泌体还可以用于分析研究)的30个乳腺癌患者血样,和6个健康人的血样。他们分离出血液里面的微囊泡和外泌体,利用质谱分析蛋白磷酸化状况。最终他们累计找到了近10000个磷酸化的蛋白,其中有144个磷酸化蛋白在乳腺癌患者血样囊泡中的量显着高于健康人。
显然,陶教授团队的初步研究表明,囊泡里的磷酸化蛋白具有作为癌症标志物的潜力,「这个研究肯定是一个突破,说明用囊泡中的磷酸化蛋白检测癌症是可行的。」
8.M1极化的巨噬细胞的外泌体可作为癌症疫苗的免疫增强剂
doi:10.1016/j.ymthe.2017.02.007

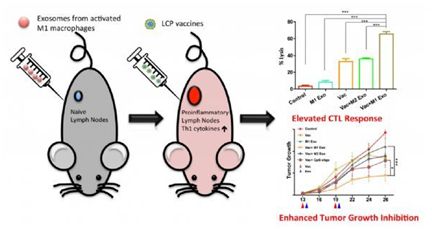
外泌体是由大多数细胞产生的小膜泡颗粒,用于细胞间通讯和调节。在其形成过程中,特定脂质、RNA、蛋白质和碳水化合物被富集并包装到囊泡中,使得外泌体内容物不仅反映亲本细胞的来源,而且反映其生理条件。这些外泌体将材料或信号传输到靶细胞以用于多种生理目的。
来自美国北卡罗莱纳大学教堂山分校的研究人员在最新的Molecular Therapy发表文章,研究了源自M1极化的促炎症巨噬细胞的外泌体,探究了使用M1外泌体作为癌症疫苗的免疫增强剂的可能性。M1外泌体在皮下注射后显示向淋巴结的倾向性,主要被局部巨噬细胞和树突细胞吸收,并诱导Th1细胞因子的释放。研究发现M1,但不是M2,外泌体增强脂质磷酸钙(LCP)纳米粒包封的Trp2疫苗的活性,并诱导更强的抗原特异性细胞毒性T细胞反应。当与黑素瘤生长抑制研究中的LCP纳米颗粒疫苗一起使用时,M1外泌体被证明是比CpG寡核苷酸更有效的免疫增强剂。因此,该研究表明源自M1极化巨噬细胞的外泌体可以用作疫苗佐剂。
9.血液中的哨兵:纳米粒子辅助量化肿瘤特异外泌体用于胰腺癌诊断
doi:10.1038/s41551-016-0021
近日,美国亚利桑那州立大学“VirginiaG.Piper个体化诊断生物设计”研究中心的胡晔教授和他的同事们设计了一种精巧的方法,来解决胰腺癌早期诊断的问题。这种诊断方法的基本原理是对血液中的肿瘤特异细胞外泌体(extracellular vesicles,EVs)的高灵敏检测。
在NatureBiomedicalEngineering杂志最新在线发表的这项研究中,胡教授和他的同事报道了该方法:它能够直接检测源自肿瘤细胞的EVs,这些囊泡上携带了特定的膜蛋白作为胰腺癌的标志物。准确测定这种名为EphA2的膜蛋白,使得这些肿瘤EVs能够用于诊断早期胰腺癌。
这项工作通过两个不同纳米粒子之间的相互作用检测肿瘤分泌的EVs,进而可利用这种方法将胰腺癌患者的血液样品与胰腺炎患者(与胰腺癌有相似的症状)及健康人的血样区分开来。更重要的是,不同疾病都有其特异性的EVs,因而这种技术能够进一步用于更广泛疾病类型的快速灵敏检测。
研究显示,在许多疾病中,循环系统中的EVs数量会显着升高。在特定癌症的发生和发展中,EVs也扮演了重要的角色,包括胰腺癌。肿瘤EVs离开其母体细胞,迁移到其他正常组织,能够影响目标组织的周围环境,创造出一个适合肿瘤浸润和生长的微环境,这是EVs在肿瘤转移中的一个显着功能。就像新大陆的拓荒者,EVs能够为后续癌细胞的入侵开辟道路。
10.超分辨率荧光显微镜技术成功运用于外泌体的成像和追踪
doi:10.1021/acsami.6b09442

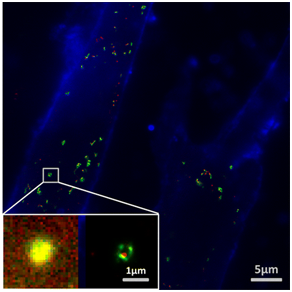
目前,各种超分辨率显微镜的出现为外泌体的研究提供了强大的工具。2016 年 9 月,东南大学先进光子学中心主任崔一平教授团队在 ACS applied materials & interfaces 杂志(IF=7.145)发表文章,展示了超分辨率成像技术(PALM / STORM)的单分子定位在癌症外泌体的成像和示踪上应用。
在实验中,首先从肿瘤细胞的培养基中提取癌细胞来源的外泌体。然后将外泌体膜受体标记上光控探针,通过光敏定位显微镜(PALM)或随机光学重构显微镜(STORM)即可对这些膜受体进行超分辨率成像。使用人类乳腺癌细胞来源的外泌体,发现对外泌体的 2 种膜受体同时标记可利用 PALM/STORM 同时成像。成功地对外泌体进行标记和成像使得研究人员能够观察癌症外泌体和正常细胞之间的相互作用。同时,PALM/STORM 成像显示癌症外泌体与受体细胞的溶酶体是共定位的。由于外泌体在细胞间通信过程中起到了至关重要的作用,研究人员预计 PALM/STORM 对外泌体的成像和追踪在外泌体介导的肿瘤转移的机制研究过程中具有很大的潜力。
11.PNAS:只需 25 分钟,华人学者带来外泌体提取新突破
doi:10.1073/pnas.1709210114
近日,麻省理工学院(MIT)和杜克大学(Duke University)的研究人员在《PNAS》上发表文章,他们开发了一种新型设备,能利用声波技术,快速从血液样品中分离外泌体(exosome)。外泌体是细胞分泌的一种纳米级别的小囊泡,直径约为 30 至 150 纳米,它们携带重要的信息,包括蛋白质、miRNA 等,帮助细胞之间通信。以前的研究表明,外泌体内容物可以作为诸如癌症,神经变性疾病和肾脏疾病等疾病的标志物。在精准医疗时代,这项技术可能在未来的疾病诊断和治疗中发挥重要作用。
但是现有的外泌体分离方法需要高速离心,需要使用大型机器,耗费近 24 小时的时间才能获得,非常不便。而高离心力也可能破坏囊泡。降低样品的质量。这项研究有望解决这一难题。在论文中,研究人员们提供了一种通过微流体和声学的独特组合从体液样品中捕获外泌体的新颖方法。他们开发的原始声学分选装置由两个倾斜的声学换能器和一个微流体通道组成,当这些传感器产生的声波相互碰撞时,形成产生一系列压力节点的驻波。每当细胞或颗粒流过通道并遇到一个节点时,压力会将细胞引导离开中心一点点。细胞移动的距离取决于大小和其他属性(如可压缩性),这样,当到达通道末尾时,不同大小和性质的细胞就能够被分离开来。这种方法分离得到的外泌体,基本上不改变其生物或物理特征,为开发评估人类健康以及疾病诊断和进展提供了有吸引力的新方法。
为了分离外泌体,研究人员用两个这样的单元串联构建了一个装置。首先,使用声波从血液样品中除去细胞和血小板。一旦细胞和血小板被去除,样品进入第二个微流体单元,然后使用较高频率的声波将外泌体与稍大的细胞外囊泡分开。这项工作的通讯作者之一,麻省理工学院材料科学与工程系科学家 Ming Dao 博士说:“声波更温和。而且在分离时,这些囊泡受处理的时间只有 1 秒钟或更短。这是一个很大的优势。”使用该设备,处理 100 微升未稀释血液样本只需要不到 25 分钟。“这种新技术可以解决当前外泌体分离技术的缺点,如周期长,一致性差,产量低,污染以及完整性受损等。我们想要把提取高质量的外泌体的过程简化为按一个按钮就在 10 分钟内获得所需样品一样简单。”研究人员们说。(生物谷 Bioon.com)
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。